HSF1とHSF3が協調的に爬虫類の熱ショック応答を制御する
HSF1 and HSF3 cooperatively regulate the heat shock response in lizards
Takii R, Fujimoto M, Matsuura Y, Wu F, Oshibe N, Takaki E, Katiyar A, Akashi H, Makino T, Kawata M, and Nakai A.
PLoS One (July 7) 12(7): e0180776, 2017. https://doi.org/10.1371/journal.pone.0180776
すべての生物は、タンパク質のミスフォールディングを容易に導く温熱ストレスに感受性が高い。この温度上昇に適応するために、細胞はタンパク質フォールディングを介助するシャペロン(熱ショックタンパク質HSPとも呼ばれる)の発現を誘導する「熱ショック応答」の仕組みを備えている。シャペロンの発現を転写レベルで誘導するのが熱ショック転写因子HSFであり、脊椎動物細胞には4つのファミリー因子(HSF1-HSF4)が存在する。
これまでに、哺乳類と鳥類のHSF群の詳細な解析がなされており、前者ではHSF1、後者ではHSF3が熱ショック応答のマスター制御因子であることが明らかとなっている。哺乳動物細胞のHSF1は、単一で存在するショウジョウバエのHSFと同様に不活性型の単量体から活性型の三量体へと転換をすることなどから、ショウジョウバエHSFの相同分子種(オルソログ)と考えられている(図1)。一方、ニワトリHSF3は二量から三量体へと転換する独特の調節であることから長い間、鳥類特異的であると考えられていた。
本研究では脊椎動物でのHSFの進化を解明するために、爬虫類および両生類のHSF遺伝子ファミリーの分子クローニングを行った。予想されるアミノ酸配列を比較したところ、HSF3は例外的に種間での相同性が低かった(図2)。驚いたことに、これらの細胞ではHSF3はHSF1とともに熱ストレス条件下でシャペロンの転写を顕著に誘導する活性を持っていることが分った。さらに、トカゲ細胞のHSF3およびHSF1の遺伝子ノックダウンにより、これらの因子の機能が重複したものではなく、互いに協調的に熱ショック応答を制御することが分った。以上の結果は、HSF3を介する熱ショック応答の仕組みが哺乳動物を除く脊椎動物で広く使われていることを示唆している(図1)。

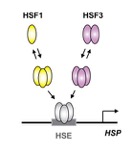
図1 鳥類、爬虫類、両生類の熱ショック応答
HSF1は不活性型の単量体から活性型の三量体へと転換をする。HSF3は二量から三量体へと転換してプロモーターへ結合し、転写を誘導する。
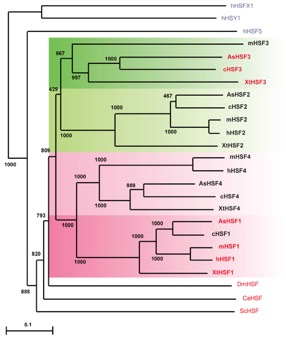
図2 哺乳動物HSF群の系統樹
ヒト(h)、マウス(m)、ニワトリ(c)、トカゲ(As, Anolis sagrei)、カエル(Xt, Xenopus tropicalis)、ショウジョウバエ(Dm)、線虫(Ce)および酵母(Sc)のHSFを示す。熱ショック応答を担うHSFを赤字で示す。