PARP1はHSF1のDNA結合を促進することで熱ショック応答を増強する(医化学講座)
Poly(ADP-Ribose) polymerase 1 promotes the human heat shock response by facilitating heat shock transcription factor 1 binding to DNA.
Fujimoto M, Takii R, Katiyar A, Srivastava P, and Nakai A.
Mol. Cell. Biol. 38, e00051-18, 2018. doi:10.1128/MCB.00051-18
熱ショック応答(HSR)は、細胞のプロテオスタシス容量低下に対する適応機構であり、シャペロン(HSP70など)の発現誘導を特徴とします。この応答を制御するのが熱ショック転写因子HSF1です。私たちはこれまでに、HSF1がPARP13を介してPARP1と複合体を形成し、DNA損傷時のDNA修復を促進することを示しました(Fujimoto et al, Nat. Commun. 2017)。しかし、HSF1-PARP13-PARP1複合体のHSRにおける役割や分子機構については不明のままでした。
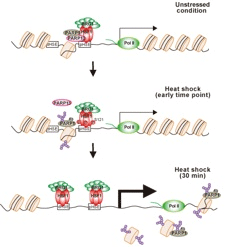
今回、私たちは、HSP70の熱ストレス時の転写誘導に焦点を当てて、この複合体の役割を明らかにしました。非ストレス条件下で、HSF1-PARP13-PARP1はHSP70プロモーターに結合していました(図1)。熱ストレス条件下では、PARP1は自己PAR化により複合体から解離し、最初はプロモーター領域、その後遺伝子コード領域へと移動することが分りました。その結果、HSF1のプロモーターへの急速で顕著な結合が促進され、HSP70の転写誘導とプロテオスタシス容量の増加が亢進されることが分りました。HSF1-S121のリン酸化によるPARP13の解離もこの一連の過程を促進しました(図1)。さらに、HSF1-PARP13-PARP1はDNA損傷ストレスによって解離するため、あらかじめDNA損傷ストレスに曝されると、熱ショック応答が減弱することも分りました。
哺乳動物細胞では、少量のHSF1はRPAと複合体を形成することであらかじめヌクレオソーム構造をとるDNAに結合し、それがストレス時の顕著なHSF1結合を導くことが知られています(Fujimoto et al, Mol. Cell 2012)。本研究によって、HSF1が急激にDNAへ結合するための新たな準備機構が明らかとなりました。

図1 熱ショック応答の分子機構