ミトコンドリアの機能を保つ仕組みを解明
【背景】
環境ストレスや代謝異常は、細胞内のいたるところでタンパク質の構造の異常をひき起し、老化や老化と関連する神経変性疾患群(アルツハイマー病など)の病気の進行を促進します。このような異常に対して、細胞には遺伝子発現を介してタンパク質ホメオスタシスの容量(あるいはプロテオスタシス容量*1)を維持する仕組みが備わっています。このような細胞の適応機構は一般に「タンパク質毒性ストレス応答*2」と呼ばれます。このときに誘導されるのが異常タンパク質の修復あるいは分解を促進するストレスタンパク質群です。これまでに、細胞質や核でのタンパク質の異常は、転写因子HSF1*3の核移行を促し、DNAへの結合活性を増強することでストレスタンパク質群の発現を誘導することが分っています(図1)。この適応機構は、熱ショック応答と呼ばれています。
ミトコンドリアは、酸素を利用してエネルギーを産生し、一方で細胞死のシグナルを伝達する重要な細胞内小器官です。もともとは、好気性細菌であるαプロテオバクテリアが、嫌気性の古細菌であるメタン菌へ共生*4して獲得されたと考えられています。ミトコンドリアは自立性に複製する独自のゲノムを持ちますが、ミトコンドリアのタンパク質の95%以上は核のゲノムにコードされており、細胞質で合成されてミトコンドリア内へ運ばれます。これらミトコンドリアのタンパク質の異常を感知してゲノムへ伝える仕組み(ミトコンドリアストレス応答UPRmt)が精力的に解析されており、線虫では転写因子ATSF-1*5が同定されています。しかし、ヒトをはじめとする脊椎動物におけるATFS-1の機能相同体は同定されていません。
【研究の成果】
研究グループは、以前の報告で、ヒトHSF1と相互作用する約30のタンパク質を同定していました。その中で、ミトコンドリアに局在するSSBP1(mtSSBとも呼ばれる)に焦点を絞って解析を行いました。SSBP1は進化の過程で良く保存された一本鎖DNA結合タンパク質で、ミトコンドリアDNAの複製やその代謝を担う因子です。SSBP1はHSF1のオリゴマー形成ドメインへ結合しました(図2)。SSBP1がヒトHSFファミリーのすべてに結合することから、結合に必要なアミノ酸を調べたところ、様々な種のHSF1で保存された188番目のリシン残基(一文字表記でK)が必須であることが分りました。次に、SSBP1が熱ショック応答に関与しているかどうかを調べました。マウス胎児線維芽細胞を用いてSSBP1をノックダウンすると、温熱ストレスによるストレスタンパク質HSP70の誘導は顕著に減弱しました(図3)。内在性のHSF1を、相互作用変異体(HSF1-K188AあるいはHSF1-K188G)へ置換した場合も同様であることから、SSBP1が温熱ストレスによるHSP70の転写誘導を増強していると結論づけました。
SSBP1の細胞内局在を調べるために、蛍光タンパク質GFPとの融合タンパク質SSBP1-GFPをHeLa細胞へ発現させました。ミトコンドリアは、ミトコンドリア外膜タンパク質であるTOM20の抗体で染色しました。非ストレス条件下では、SSBP1-GFPとTOM20はミトコンドリアに共局在していました。温熱ストレスにより、SSBP1-GFPのみが一部、核へ移行しました。ミトコンドリア移行シグナルを除いたSSBP1-GFPは、温熱ストレスにより全て核へ局在することも分りました。次に、免疫染色にて内在性SSBP1の局在を調べたところ、やはり温熱ストレスによりSSBP1の一部が核へ移行しました(図4)。核、細胞質、ミトコンドリアの細胞画分に分離して、それぞれの画分におけるSSBP1の量を調べたとこと、ミトコンドリアのSSBP1は温熱ストレスにより減少し、核のSSBP1は増加しました。プロテアソーム阻害剤やアミノ酸アナログ処理によってもSSBP1の核への移行を認めましたが、ミトコンドリア電子伝達系阻害剤処理や低酸素などのストレスでは核移行を認めませんでした。これらの結果は、SSBP1がタンパク質毒性ストレス特異的に核へ移行して転写を調節することを示します。SSBP1は核局在化シグナルを持たず、HSF1と相互作用することで核へ運ばれることも分りました。
SSBP1のミトコンドリアからの排出は何が引き金となるのでしょうか。ミトコンドリア膜電位はミトコンドリア機能の指標となり、多くはミトコンドリアのpermeability transition pore(PTP)*6の開口を伴っています。PTPの開口は、シクロスポリンAで抑制を受け、PTP構成因子と推定されるVDACの機能欠失でも抑制される場合があることが知られています。今回、温熱ストレスは確かにPTPの開口を導き、それはスクロスポリンA処理やVDAC1ノックダウンで抑制されることを示しました。同じ処理によって、温熱ストレスによるSSBP1の核への移行およびHSP70誘導も抑制されました(図5)。後者の抑制は、ミトコンドリア移行シグナルを欠失したSSBP1を高発現させることで解除されました。これらの結果は、PTPの開口と膜電位の低下がSSBP1のミトコンドリアからの排出の引き金になることを示します。
次に、SSBP1が核内でどのようにHSF1による転写活性を増強するか調べました。SSBP1ノックダウンは、HSF1の単量体から活性型である三量体への転換、さらにはHSP70プロモーターへの結合に影響を与えません。驚いたことに、SSBP1はHSF1が結合するのと同じ領域へ集積していました(図6)。この集積はHSF1がないと全く認めません。温熱ストレス条件下では、HSF1は巨大な転写複合体*7を形成して転写を促進します。その複合体の一つであるBRG1を含むクロマチン再構成複合体の集積を調べたところ、SSBP1ノックダウンにより減少することが分りました。同様の処理で、RNAポリメラーゼII(Pol II)の集積も減少しました。つまり、SSBP1は、HSF1 転写複合体へのBRG1やPol IIの集積を促進することで転写を増強することが分りました。
SSBP1が制御するターゲット遺伝子群を網羅的に調べるためにDNAマイクロアレイ解析によりmRNAの発現を調べました。その結果、10個の細胞質•核に局在するストレスタンパク質と2つのミトコンドリアに局在するストレスタンパク質*8(HSP60、HSP10)が温熱ストレスにより誘導されることが分りました(図7)。HSF1をノックダウンすると誘導は見られなくなり、SSBP1ノックダウンにより全ての誘導が低下しました。タンパク質の発現もこの結果と一致していました。さらに、これらの遺伝子プロモーターには確かにHSF1-SSBP1複合体が存在していました(図7)。つまり、SSBP1は一群のミトコンドリアおよび細胞質•核のストレスタンパク質の発現を制御しています。
HSF1-SSBP1複合体の生物学的意義を明らかにするために、まずはタンパク質毒性ストレス条件下での細胞の生存率を調べました。内在性のHSF1をノックダウンし、野生型HSF1あるいはHSF1の相互作用変異体(HSF1-K188AまたはHSF1-K188G)に置換した後、温熱ストレスあるいはプロテアソーム阻害剤処理して細胞の生存率を調べました。その結果、いずれのストレス条件下でも、野生型HSF1はHSF1をノックダウンした細胞の生存率の低下を回復させましたが、相互作用変異体は回復させることができませんでした。さらに、ミトコンドリア機能と関連するミトコンドリア膜電位差(Dym)*9を調べました。やはり、野生型HSF1はHSF1をノックダウンした細胞のDymの低下を回復させましたが、相互作用変異体は回復させることができませんでした(図8)。これらの結果は、HSF1-SSBP1複合体がタンパク質毒性ストレス条件下で、細胞生存およびミトコンドリア機能の維持に働くことを示唆しています。
【研究の意義と今後の展望】
本研究は、哺乳動物細胞のミトコンドリアストレス応答の経路を世界で初めて明らかにしました。線虫と同様に、ミトコンドリアストレスを感知して転写誘導へと導く因子はミトコンドリアに局在する因子でした。驚くべきことは、SSBP1自身は転写因子ではなく、熱ショック応答を調節する転写因子HSF1と相互作用し、HSF1を介してDNAに結合して転写を促進することです(図9)。タンパク質毒性ストレスは全てHSF1を活性化してストレスタンパク質を誘導しますが、同時にSSBP1のミトコンドリアからの排出も促していました。つまり、細胞質•核のストレス応答である熱ショック応答とミトコンドリアストレス応答は、哺乳動物細胞では密接に関連したものであるといえます。これは、ほとんどのミトコンドリタンパク質が細胞質で合成された後にミトコンドリアへ運ばれることを考えると納得できます。つまり、ミトコンドリアの恒常性を保つためには、ミトコンドリアのプロテオスタシス容量だけでなく、細胞質のそれを調節する必要があることを示しています。逆に、細胞質•核のプロテオスタシス容量を保つためには、ミトコンドリアのプロテオスタシス容量の調節も必要であることをも示唆しています。
近年、ミトコンドリアの機能異常は、老化や老化と関連する神経変性疾患群の進行に密接に関わっていることが線虫、ショウジョウバエ、マウス等の研究から明らかとなってきています。線虫のATFS-1が直接寿命を伸長するかは議論のあるところですが、ストレス条件下でミトコンドリアのプロテオスタシス容量を維持することは確かです。したがって、本研究成果は、HSF1-SSBP1複合体が老化や神経変性疾患群の進行を遅らせる治療ターゲットとしての可能性も示唆します。
<論文情報>
K. Tan, M. Fujimoto, R. Takii, E. Takaki, N. Hayashida, and A. Nakai. Mitochondrial SSBP1 protects cells from proteotoxic stresses by potentiating stress-induced HSF1 transcriptional activity. Nature Communications 6:6580, 2015
<問い合わせ先>
国立大学法人山口大学大学院医学系研究科 医化学分野
教授 中井 彰
TEL: 0836-22-2214 FAX: 0836-22-2315
<補足説明>
*1 プロテオスタシス容量
細胞内に生じたミスフォールディングタンパク質に対処できる容量のこと。この容量は、細胞の種類で異なっている。タンパク質毒性ストレス応答はこの容量を調節する仕組みである。一般に、プロテオスタシス容量は老化とともに低下する。タンパク質の凝集を特徴とする一群の神経変性疾患が老化とともに進行するのは、老化に伴うプロテオスタシス容量の減少が一因である。
* 2 タンパク質毒性ストレス応答
ある生育温度で維持されている細胞を、数度高い温度にさらすといわゆる熱ショックタンパク質(HSP、heat shock protein)あるいはストレスタンパク質とよばれる多種類のタンパク質群が誘導される。これはすべての生物がもつ細胞質と核のタンパク質変性に対する適応機構であり、熱ショック応答(HSR、heat shock response)とよばれる。誘導されたHSPは、細胞質と核の異常タンパク質の修復あるいは分解を促進する。一方で、ミトコンドリア内のタンパク質の変性に対してはミトコンドリアストレス応答(UPRmt、unfolded protein response in the mitochondria)、小胞体内のタンパク質の変性に対しては小胞体ストレス応答(UPRER、unfolded protein response in the ER)によって別の一群のストレスタンパク質が誘導される。
*3 転写因子HSF1
熱ショック因子(HSF1、heat shock factor 1)は、遺伝子の読み取り(転写)を制御する転写調節因子として働く。ヒト細胞でストレスタンパク質HSPの量を調節するのは主にHSF1である。HSF1は温熱ストレスをはじめとする様々なストレスによるタンパク質のミスフォールディングを感知し、活性化されることでHSPをはじめとするストレスタンパク質の遺伝子上流のプロモーターへ結合し、その転写量を調節する。
*4 ミトコンドリア共生説
真核生物はすべてミトコンドリアを持つが、その起源を説明するための仮説である。ミトコンドリアや葉緑体は細胞内共生した他の細胞に由来すると考える。
*5 転写因子ATSF-1
線虫のミトコンドリアストレス応答を担う転写調節因子のひとつで、通常はミトコンドリアに移行して分解を受ける。ミトコンドリアのタンパク質の構造異常にともなって、ミトコンドリアへの移行が抑制されて、核へ蓄積してミトコンドリアで働くストレスタンパク質群(HSP60、HSP10、プロテアーゼLonなど)の転写を誘導する。
*6 ミトコンドリアpermeability transition pore(PTP)
PTP複合体は水や小さいイオン分子などが通過できる孔と推測されており、その構成因子については議論がある。VDAC-ANT複合体はその候補の一つである。一般に、PTPの開口は細胞死を導くきっかけとなると考えられており、アポトーシスを促進するシトクロームCやAIFの放出をともなう。しかし、SSBP1の核移行を促す温熱ストレス(42℃、60分)ではアポトーシスもアポトーシス促進因子の放出も起こらない。
*7 HSF1転写複合体
哺乳動物細胞が温熱ストレスに曝されると、巨大なHSF1転写複合体が形成されると推測されている。主要な構成因子としては、転写を促進するクロマチン再構成因子複合体(BRG1を含む)、回復期にHSF1のアセチル化を介して不活性化させるp300/CBP、それらのリクルートを促進する転写因子ATF1/CREBなどが含まれる。
*8 ミトコンドリアに局在するストレスタンパク質
タンパク質の異常構造を修復する熱ショックタンパク質であるHSP60、HSP10、mtHSP70、そして分解に関わるLon、ClpPなどが知られている。これらは全てSSBP1によって発現調節を受けている。HSP60とHSP10の遺伝子は隣り合っており、共通のプロモーターの支配を受ける(図7参照)。
*9 ミトコンドリア膜電位差(Dym)
ミトコンドリア内膜では電子を運搬しながら、そのエネルギーを利用して膜間腔へプロトンを汲み上げている。この内膜を挟んだプロトン勾配を利用して内膜にあるATP合成酵素がATPを合成してゆく。したがって、Dymはミトコンドリア機能と密接に関連している。脱共役剤などでミトコンドリア内膜に孔を開けるとプロトン勾配が消失してエネルギー産生が止まる。
<図と説明>

図1 主要な3つのタンパク質毒性ストレス応答
細胞質と核のタンパク質変性に対する適応機構は熱ショック応答(HSR)とよばれる。タンパク質変性のシグナルは転写因子HSF1へ伝えられ、細胞質と核の異常タンパク質の修復あるいは分解を促進する一群のストレスタンパク質HSPが誘導される。一方で、ミトコンドリア内のタンパク質の変性に対してはミトコンドリアストレス応答(UPRmt)、小胞体内のタンパク質の変性に対しては小胞体ストレス応答(UPRER)によって別の一群のストレスタンパク質が誘導される。
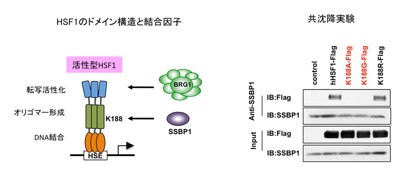
図2 SSBP1はHSF1のオリゴマー形成ドメインに結合する
HSF1のオリゴマー形成ドメインは疎水性アミノ酸の7回ごとの繰り返しからなるが、その隣に位置するリシンK188はSSBP1との結合に必須である(左)。一方、コアクチベーターの一つであるBRG1を含むクロマチン再構成複合体は転写活性化ドメインに結合する。188番目のリシン(K)をアラニン(A)またはグリシン(G)に置換した変異体(hHSF1-K188A、hHSF1-K188G)は、共沈降実験でSSBP1との結合が検出されない(右)。
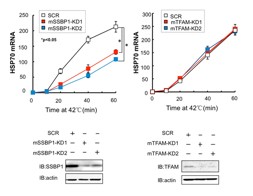
図3 SSBP1は熱ストレスによるHSP70誘導を促進する
MEF細胞のSSBP1をノックダウン(mSSBP1-KD1 or KD2)して42℃の温熱ストレスに曝した。HSP70 mRNAを定量RT-PCRで調べた(左)。*印は有為差を示す(p<0.05、ANOVA検定)。SSBP1ノックダウン細胞ではHSP70 mRNA誘導が顕著に低下した。同じくDNA代謝に関与するTFAMをノックダウンした細胞でも同様の実験を行ったが、HSP70 mRNA誘導に差異を認めなかった(右)。
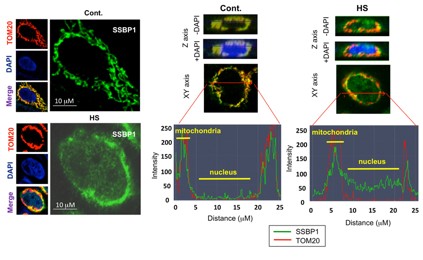
図4 ミトコンドリアSSBP1は熱ストレスにより核へ移行する
コントロールの状態(Cont.)と熱ストレスに曝した(HS)HeLa細胞をSSBP1抗体、ミトコンドリア外膜タンパク質TOM20抗体、DAPIで染色して共焦点顕微鏡で観察した(左)。Z軸とXY軸の断面像を作製し、後者のSSBP1とTOM20のシグナルを定量化した(右)。コントロール細胞ではミトコンドリアにSSBP1とTOM20のシグナルを認め、核にはない。温熱ストレスに曝した細胞では、SSBP1のシグナルの一部が核に認められる。
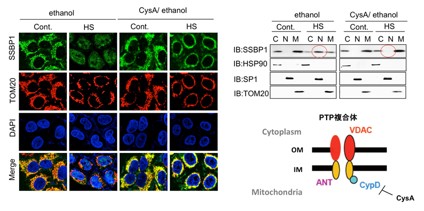
図5 VDAC1-ANT複合体がSSBP1の核移行と関連する
ミトコンドリアのPTP複合体の構成は明らかにされていないが、シクロスポリンでその開口が抑制されることが知られている。実際に、熱ストレスによりPTP開口が認められ、シクロスポリンA処理で抑制される。同時に、シクロスポリン処理は、SSBP1の核移行も抑制した(左)。細胞質(C)、核(N)、ミトコンドリア(M)の細胞分画に分けてSSBP1の局在をウエスタンブロットで調べることで、この結果がさらに検証された(右、赤丸は核内SSBP1を示す)。
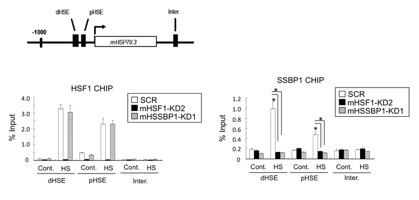
図6 HSF1はSSBP1をHSP70プロモーターへリクルートする
HSP70プロモーターには近位および遠位の熱ショックエレメント(pHSEおよびdHSE)が存在する。ストレスのない条件下では、HSF1がわずかにpHSEへ結合しており、熱ストレスによりHSF1は両方のHSEへ大量に結合する(左)。HSF1のDNA結合は、SSBP1ノックダウンで影響を受けない。意外なことに、SSBP1もHSF1依存的にこれらのHSEへ集積した(右)。
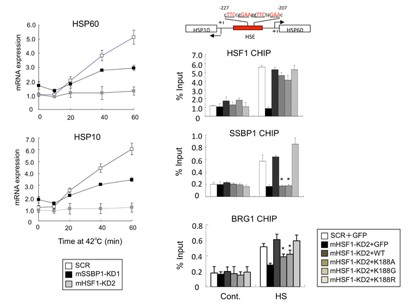
図7 SSBP1はミトコンドリアHSP60とHSP10の発現を促進する
MEF細胞のSSBP1(mSSBP1-KD1)あるいはHSF1(mHSF1−KD1)をノックダウンして42℃の温熱ストレスに曝した。HSP60とHSP10 mRNAを定量RT-PCRで調べた(左)。共通のプロモーターへのHSF1、SSBP1、BRG1の集積をChIPアッセイで調べた(右)。HSF1をノックダウンした細胞へ、野生型HSF1、相互作用変異体(hHSF1-K188A、hHSF1-K188G)を発現させた。SSBP1は、HSF1依存的にプロモーターへリクルートされ、BRG1のリクルートを促すことが示された。
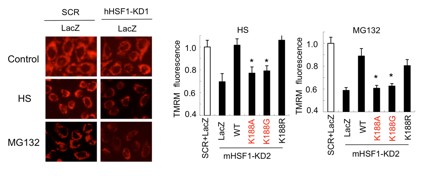
図8 SSBP1はミトコンドリア膜電位差を維持する
ミトコンドリア機能と関連するミトコンドリア膜電位差(Dym)を、タンパク質毒性ストレス条件下(温熱ストレスHSとプロテアソーム阻害剤MG132)で調べた。HSF1欠損は、これらストレスによって低下する膜電位差をさらに低下させた(左)。そこで、内在性のHSF1をノックダウンし、野生型HSF1あるいはHSF1の相互作用変異体(HSF1-K188AまたはHSF1-K188G)に置換した後、温熱ストレスあるいはプロテアソーム阻害剤処理してミトコンドリア膜電位差(Dym)を調べた(右)。野生型HSF1はHSF1をノックダウンした細胞のDymの低下を回復させたが、相互作用変異体は回復させることができなかった。*印は有為差を示す(p<0.05、Student t検定)。
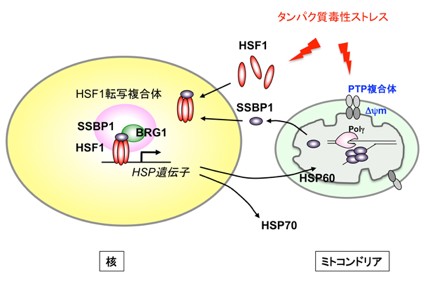
図9 哺乳動物細胞のミトコンドリアストレス応答の経路
タンパク質毒性ストレスはHSF1を活性化すると同時に、ミトコンドリアPTP開口や膜電位差の低下を介してSSBP1の排出を促す。SSBP1はHSF1とともに核へ移行し、転写複合体の形成に一躍を担う。その結果、発現誘導されたミトコンドリアストレスタンパク質がミトコンドリア機能を維持する。