研究の概要
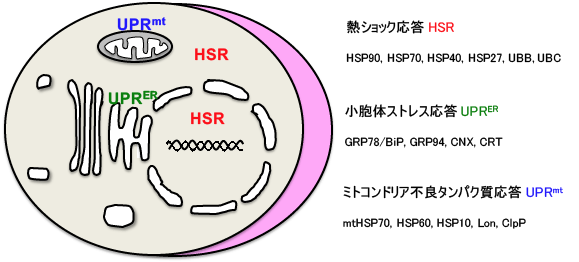
わたしたちのからだを構成する正常な細胞内のタンパク質は、その量と質がほぼ一定に保たれています。これはタンパク質ホメオスタシス(protein homeostasis、またはプロテオスタシスproteostasis)が維持されている状態であり、タンパク質の合成、フォールディング、分解、局在等によって保たれています。外的環境や代謝の変化は細胞内のいたるところでタンパク質のミスフォールディングによる構造異常(変性とも呼ばれる)を引き起こします。このタンパク質の変性に適応するために、細胞は遺伝子発現を介した複数のタンパク質毒性ストレス応答(proteotoxic stress response, PSR)機構を備えています。その中で、大腸菌からヒトまでの進化の過程で保存された仕組みが熱ショック応答(heat shock response, HSR)です。HSRはシャペロンとして働く熱ショックタンパク質(HSP)とタンパク質分解酵素(UBBやUBCにコードされるユビキチンなど)の発現誘導を特徴とします。真核細胞は核、小胞体やミトコンドリアなどの細胞内小器官を備えており、主に核・細胞質のタンパク質ミスフォールディングに対する適応機構がHSRです。一方、小胞体とミトコンドリアにおける同様の適応機構はそれぞれ小胞体ストレス応答(unfolded protein response in the ER, UPRER)およびミトコンドリア不良タンパク質応答(mitochondrial UPR, UPRmt)と呼ばれ、やはり各々の小器官で働くシャペロンとタンパク質分解酵素などが誘導されます。HSRは、熱ショック転写因子(HSF)によって転写のレベルで調節されています。HSFはまた、UPRmtの際のミトコンドリアHSPの発現誘導にも必要なこともわかってきました。このHSF-HSP経路を介するプロテオスタシス容量の調節は、生理的そして外的環境変化から細胞を保護するために必要であり、その機能欠損は線虫の老化、あるいはポリグルタミン病などのタンパク質ミスフォールディング病モデル線虫の病態を進行させることが知られています。
高等動物細胞では4つのHSF(HSF1-4)が存在します。哺乳動物細胞ではHSF1が熱ストレスによるHSPの誘導を担い、それ以外はHSP誘導を修飾します。私たちは、世界に先駆けて、哺乳動物細胞のHSF群がタンパク質ミスフォールディング病に及ぼす効果、ならびにその効果を生じるプロテオスタシス経路の解析を行ってきました。まず、HSF1の機能獲得がミスフォールディング病モデルマウスの病態を改善し寿命を伸長すること、さらにHSF1欠損はその病態進行を促進し寿命を短縮することを示しました。その効果は、HSP経路だけでなく、タンパク質分解経路を含む複数のnon-HSP経路を作動させることによるものであることを初めて明らかにしました。この発見は、HSP発現に必要でないHSF群の機能について再考を促すこととなりました。その結果、HSF2が発熱レベルの生理的な熱ストレスで活性化されて細胞生存に必要であること、HSF2欠損はやはりタンパク質ミスフォールディング病モデルマウスの病態進行を促進して寿命を短縮することを明らかにしました。一方、私たちが独自に解析してきたHSF4はレンズの維持に必要であり、その変異はヒトの遺伝性白内障と関連することも分りました。
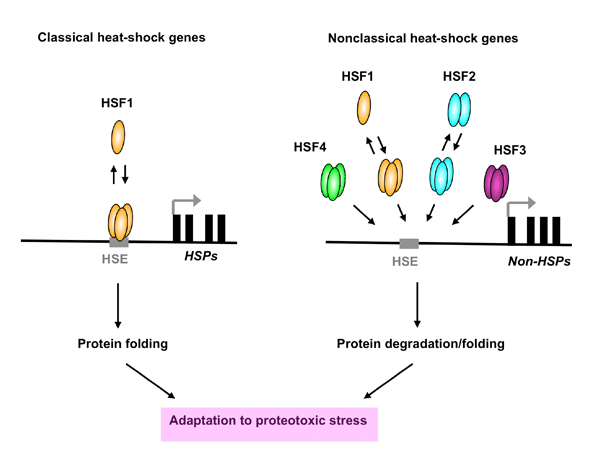
さらに、マウスHSF3もポリグルタミン蛋白質の凝集を抑制できることを示しました。これらの世界的にも独創的な研究から、HSF群が共通経路とそれぞれ独自の経路を介してタンパク質ホメオスタシスを調節することが結論づけられ(下図参照)、進化の過程でHSF遺伝子群が、プロテオスタシス容量の調節のために異なる経路を制御するようになったことが推測されます。
現在、プロテオスタシス容量の調節機構をさらに探求するために、HSFによるクロマチン制御(エピゲノム調節)による転写調節機構に焦点を当てて研究を進めています。これまで、ショウジョウバエHSFによるHSRにおけるHSP70遺伝子の転写機構がよく研究されてきました。しかし、HSP70遺伝子の転写誘導機構、および個体発生過程やストレスのない通常の細胞生育条件での転写調節機構など、哺乳動物細胞における生理的条件下での制御機構は不明でした。私たちは、HSF群と相互作用するタンパク質を網羅的に同定することで、HSP転写調節にかかわるHSF転写複合体の構成因子群を次々に明らかにしてきました(下図参照)。第1に、HSF1はDNA複製・修復に関与するRPAと相互作用することでクロマチンへ結合できることが分かりました。RPAは非ストレス条件下でHSF1が機能するための必須のパートナー因子です。第2に、クロマチンへ結合したHSF1は構成的にPARP13-PARP1をリクルートしていることもわかりました。この複合体は定常状態の遺伝子発現の調節を行うだけでなく、その後の熱ストレス時の誘導にもポリADPリボシル化によるクロマチン弛緩に重要な役割を担います。さらにこの複合体は、プロテオスタシス容量の調節だけでなくDNA修復にも重要です。第3に、PLK1によるHSF1-S419リン酸化はTRRAP-TIP60 ヒストンアセチルトランスフェラーゼ複合体をリクルートすることを見出しました。TIP60とp300によるヒストンアセチル化(H3K18acとH3K23ac)はTRIM33とTRIM24に認識され、これらのTRIMタンパク質はヒストンH2B-K120をモノユビキチン化を介してHSP 遺伝子のクロマチンを弛緩させ、転写を促進することが明らかになりました。第4に、HSF1の活性と関連するSer326リン酸化がシュゴシンSGO2のリクルートを介してRNAポリメラーゼII(PolII)の集積を促進することも見出しました。最後に、それ以外のコアクチベーターとして糖・脂質代謝を制御する転写因子ATF1やミトコンドリアDNA複製・修復に関与するSSBP1(mtSSB)などが明らかにされ、代謝とHSRとの関連が明らかになってきました。今後、HSFの活性化調節機構、HSFによるエピゲノム調節機構とプロテオスタシス経路をさらに解明していきます。

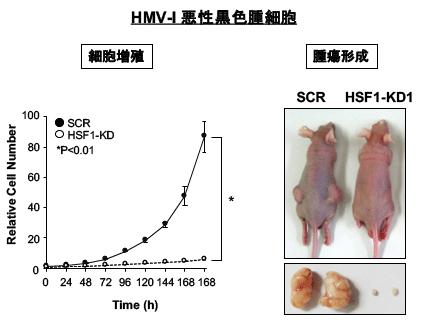
HSRを制御するこれらHSF1転写複合体は疾患と密接に関連することがわかってきました。例えば、HSF1-RPA複合体の形成はヒト悪性黒色腫細胞の腫瘍形成に必須であり、その相互作用の阻害は腫瘍形成を阻止します。HSF1-S419リン酸化も腫瘍形成に見分けて重要であルコともわかっています。今後は、新たなHSRの分子機構が、老化、タンパク質ミスフォールディング病、がん、神経精神疾患をはじめとする難治性疾患群に関連することを示すことで、それらに対する新規治療ターゲットを提案していきたいと考えています。
最近の代表論文
1) Takii R, Fujimoto M, Pandey A, Jaiswal K, Shearwin-Whyatt L, Grutzner F, and Nakai A. HSF1 is required for cellular adaptation to daily temperature fluctuations. Sci. Rep. 14, 21361, 2024, September 12, 2024, DOI: 10.1038/s41598-024-72415-x.
2) Okada M, Fujimoto M, Srivastava P, Pandey A, Takii R, and Nakai A. The Mediator subunit MED12 promotes formation of HSF1 condensates on heat shock response element arrays in heat-shocked cells. FEBS Lett. 597 (13), 1702–1717, 2023 (selected as the Editor’s Choice)
3) Fujimoto M, Takii R, Matsumoto M, Okada M, Nakayama KI, Nakato R, Fujiki K, Shirahige K, and Nakai A. HSF1 phosphorylation establishes an active chromatin state via the TRRAP-TIP60 complex and promotes tumorigenesis. Nat. Commun. 13, 4355, 2022. (Featured in a Nature Communications Editors Highlights webpage) (Press release)
4) P. Srivastava, R. Takii, M. Okada, M. Fujimoto, and A. Nakai. MED12 interacts with the heat shock transcription factor HSF1 and recruits CDK8 to promote the heat shock response in mammalian cells. FEBS Lett. 595 (14), 1933-1948, 2021.
5) A. Katiyar, M. Fujimoto, K. Tan, A. Kurashima, P. Srivastava, M. Okada, R. Takii, and A. Nakai. HSF1 is required for induction of mitochondrial chaperones during the mitochondrial unfolded protein response. FEBS Open Bio 10 (6), 1135-1148, 2020. (selected as the winner of inaugural 2021 FEBS Open Bio Prize)
6) Takii R, Fujimoto M, Matsumoto M, Srivastava P, Katiyar A, Nakayama KI, and Nakai A. The pericentromeric protein shugoshin 2 cooperates with HSF1 in heat shock response and RNA Pol II recruitment. EMBO J. 38 (24), e102566, 2019. (selected as a Cover, Introduced in News & Views) (Press release)
7) M. Fujimoto, R. Takii, A. Katiyar, P. Srivastava, and A. Nakai. Poly(ADP-Ribose) Polymerase 1 Promotes the Human Heat Shock Response by Facilitating Heat Shock Transcription Factor 1 Binding to DNA. Mol. Cell. Biol. 38, e00051-18, 2018.
8) M. Fujimoto, R. Takii, E. Takaki, A. Katiyar, R. Nakato, K. Shirahige, and A. Nakai. The HSF1-PARP13-PARP1 complex facilitates DNA repair and promotes mammary tumorigenesis. Nat. Commun. 8, 1638, 2017. (Press release)
9) K. Tan, M. Fujimoto, R. Takii, E. Takaki, N. Hayashida, and A. Nakai. Mitochondrial SSBP1 protects cells from proteotoxic stresses by potentiating stress-induced HSF1 transcriptional activity. Nat. Commun. 6, 6580, 2015. (Press release)
10) R. Takii, M. Fujimoto, K. Tan, E. Takaki, N. Hayashida, R. Nakato, K. Shirahige, and A. Nakai. ATF1 modulates the heat shock response by regulating the stress-inducible HSF1-transcription complex. Mol. Cell. Biol. 35, 11-25, 2015.
11) M. Fujimoto, E. Takaki, R. Takii, K. Tan, R. Prakasam, N. Hayashida, S. Iemura, T. Natsume, and A. Nakai. RPA assists HSF1 access to nucleosomal DNA by recruiting histone chaperone FACT. Mol. Cell 48, 182-194, 2012. (Press release)
最近の代表総説
1) 藤本充章、中井 彰 HSF1凝縮体と熱ショック応答 特集「ストレス応答と相分離」実験医学 42(13), 2022-2028, 2024.
2) Fujimoto M, Takii R, and Nakai A. Regulation of HSF1 transcriptional complexes under proteotoxic stress. BioEssays 45 (7), e2300036, 2023. (Invited Review)
3) 瀧井良祐、中井 彰 熱ショック応答における転写開始前複合体形成の調節機構 生化学 94 (1),102-107, 2022.
4) 中井 彰、瀧井良祐、藤本充章 プロテオスタシスを維持するためのミトコンドリア不良タンパク質応答 ミトコンドリアダイナミクス〜機能研究から疾患・老化まで〜 株式会社エヌ・ティー・エス、p65-p74、2021
5) 藤本充章、中井 彰 熱ショック応答によるプロテオスタシス制御と老化関連疾患 医学のあゆみ 267, 919-926, 2018.
6) Nakai A. Molecular basis of HSF regulation. Nat. Struct. Mol. Biol. 23, 93-95, 2016 (News and Views)
7) Nakai A ed. 2016. Heat Shock Factor. Springer, Japan. (eBook + Hard Cover)
8) 譚克、中井 彰 ミトコンドリアのプロテオスタシス制御 生化学 87, 758-761, 2015.
9) Fujimoto M, Takii R, Hayashida N, Nakai A. Analysis of the heat shock factor complex in mammalian HSP70 promoter. Methods Mol. Biol. 1292, 53-65, 2015.
10) 瀧井良祐、中井 彰 熱ショック因子によるプロテオスタシス制御と疾患 細胞工学 33, 706-710, 2014.
11) 藤本充章、中井 彰 RPAはヒストンシャペロンFACTをリクルートしヌクレオソームを形成するDNAへのHSF1の結合を介助するFirst Author’s. http://first.lifesciencedb.jp/archives/5716#more-5716 , 2012.
12) M. Fujimoto and A. Nakai. Novel aspects of heat shock factors: the heat shock factor family and adaptation to proteotoxic stress. FEBS J. 277: 4112-4125, 2010. (FEBS Journal Top-Cited Paper Award)
13) A. Nakai. Heat shock transcription factors and sensory placode development. BMB reports 42: 631-635, 2009.
14) 藤本充章、中井 彰 熱ストレス応答による恒常性維持の機構 第26回生化学特集「転写制御から迫る生体内環境応答機構」生化学81: 465-473、2009



