蛋白質恒常性とストレス応答
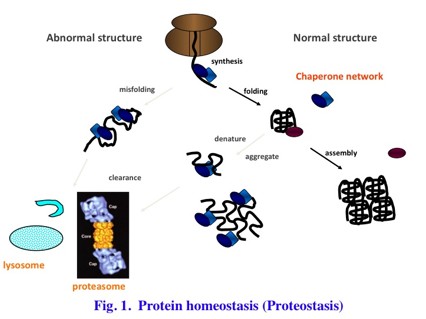
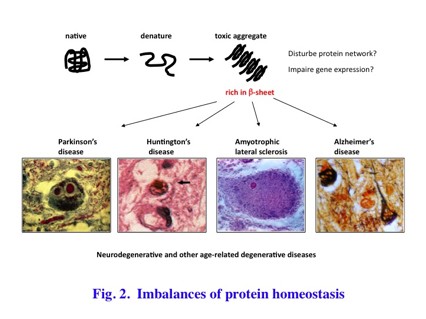
細胞は、蛋白質ホメオスタシスの維持機構、つまり細胞内に存在する蛋白質の質と量を一定に保つ仕組みを備えている。それらは、主に、蛋白質が正しくフォールディングするのを介助する過程と、まちがったフォールディングを行った蛋白質を分解する過程からなる(Fig. 1)。前者の過程は、熱ショック蛋白質群を中心とするシャペロンネットワークによって制御されている。細胞内のフォールディングの容量を超える変性蛋白質の増加は、蛋白質ホメオスタシスの破綻を招き、その結果、細胞機能異常および神経変性疾患をはじめとする疾患を引き起こす(Fig. 2)。

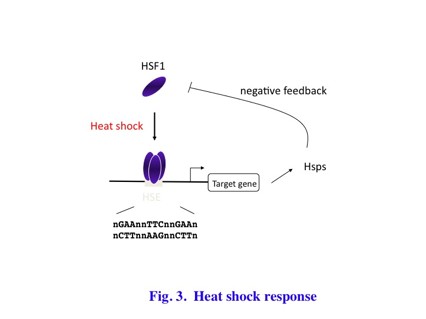
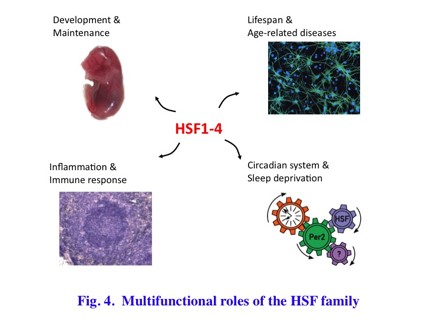
変性蛋白質を感知して、熱ショック蛋白質の量を調節するのが熱ショック転写因子HSFである。ほ乳動物細胞では、非活性型の単量体HSF1が、熱ショックなどのストレスにより活性型の三量体HSF1となって熱ショック遺伝子を活性化する(Fig. 3)。熱ショック蛋白質の増加は、フォールディングの容量を増やすことで変性蛋白質の増加に対応する。一方、細胞がストレスから回避し、熱ショック蛋白質が過剰になると、HSF1と相互作用してその活性を抑制する。HSFは遺伝子ファミリーを形成し、進化の過程でよく保存された4つのHSF遺伝子(HSF1-4)がある。それらは、個体発生、老化、炎症免疫、リズムなど様々な生理過程で重要な働きがあることが明らかとなってきた(Fig. 4)。また、HSF4は遺伝性白内障の原因遺伝子でもある。近年、熱ショック応答を薬剤等で制御することで、神経変性疾患などの治療への応用の期待が高まっている。