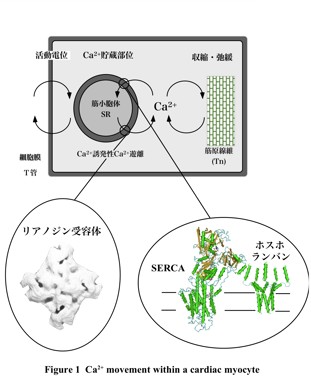
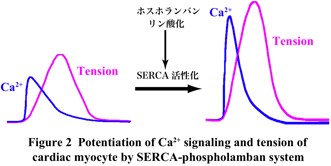
カルシウム恒常性と制御機構
細胞内のカルシウム・イオン(Ca2+)は、10-6 M以下の低濃度に保たれている。この低濃度Ca2+環境下を利用して、細胞はCa2+をシグナルとして使い様々な機能を発揮或いは調節している。心臓では、細胞内Ca2+が心筋細胞の収縮、弛緩のスイッチとなっている。この細胞内Ca2+は、主として細胞内Ca2+貯蔵部位である心筋小胞体(SR)へのCa2+の出入りで決まる(Fig. 1)。心筋小胞体からのCa2+放出は、Ca2+遊離チャネル(リアノジン受容体)が行い、Ca2+取り込みはSERCA(Ca2+-ATPase)が担っている。特に、後者には、SERCA活性を調節する調節蛋白質ホスホランバンによる制御機構が備わっている。交感神経やアドレナリンによる心筋収縮力の増強では、その作用機序としてcAMP依存性のホスホランバン燐酸化によるCa2+シグナル増強が中心的な役割を果たしている(Fig. 2)。
心臓が全身に十分に血液を拍出することが出来ない病的状態を心不全という。心不全状態の心筋では、心筋小胞体を介するCa2+の動きが極めて悪くなっており、十分な収縮・弛緩が出来ない。さらに、このCa2+は、心筋細胞に様々な変化をもたらし細胞の性質を変えてしまう。不全心筋でSERCA-ホスホランバン系を介して細胞内Ca2+動態を改善してやると、心筋収縮力が回復するのみならず細胞の性質も正常化してくる。この様に、SERCA-ホスホランバン系は、新たな心不全治療のターゲットとして期待が高まっている。