タンパク質ホメオスタシスを調節する仕組みを解明
— がん治療薬のターゲットの可能性 —
【ポイント】
・タンパク質ホメオスタシスの調節に必須のタンパク質複合体を発見
・新規タンパク質複合体は、がん細胞の増殖に必要
【概要】
山口大学は、細胞内タンパク質ホメオスタシスを調節する仕組みを分子レベルで解明し、それがマウスでの腫瘍形成に必要であることを示しました。これは、山口大学大学院医学系研究科医化学分野の中井彰教授、藤本充章講らを中心とした研究グループが、産業技術総合研究所の夏目徹主任研究員らとの連携研究で得た成果です。
タンパク質は、アミノ酸が一列に並んだひも状のもので、それが正しく折れたたまれる(フォールディングされる)ことではじめて働くことができます。不可逆的にミスフォールディングされたタンパク質は分解によって処理されます。細胞には、外界からのストレスや遺伝的要因などによって生じたタンパク質の異常を再フォールディングや分解により修復する仕組みが備わっており、その中でも重要なのが熱ショック応答と呼ばれる適応機構です。これは、フォールディングと分解を助けるストレスタンパク質群の遺伝情報の読み取り(転写)の量を調節することで、タンパク質ホメオスタシス(恒常性)を保つ仕組みです。がん細胞は、この適応機構を強く発揮させて、それを利用することで、ストレス条件下でも増殖できることが知られています。
この仕組みの働きを調節するのが熱ショック因子HSF1(Heat Shock Factor 1)とよばれる転写調節因子です。HSF1は、ストレスタンパク質をコードする遺伝子に結合することでその転写量を亢進します。しかし、遺伝子を含むDNAはヒストンタンパク質とともにヌクレオソームとよばれる構造を形成しており、通常は転写調節因子が結合できない状態で存在します。したがって、どのようにHSF1がヌクレオソーム構造をほどき、ストレスタンパク質の遺伝子に結合できるか不明でした。今回、研究グループは、HSF1がDNA代謝と関連するRPA(Replication Protein A)と複合体を形成し、それがDNAからヒストンタンパク質を除く因子を引き寄せることを発見しました。その結果、ストレスタンパク質の遺伝子に結合できたHSF1が、その転写量を調節してタンパク質ホメオスタシスを保ちます。さらに、このHSF1-RPA複合体ができない条件下では、マウスでの腫瘍形成が顕著に抑制されることも明らかとなりました。
この研究成果は、タンパク質ホメオスタシスの調節の仕組みを解明しただけでなく、一般に転写調節因子がヌクレオソーム構造をとる遺伝子に結合する仕組みを世界ではじめて明らかにしました。また、HSF1とRPAとの結合を断ち切る化合物の探索により、がんの治療薬の開発に結びつけることができると期待します。本研究は、山口大学研究推進体「ストレス応答と関連した難治性疾患の克服のための戦略」の一環として進められ、米国の科学雑誌『Molecular Cell』(8月30日付け)のオンライン版に掲載されます。

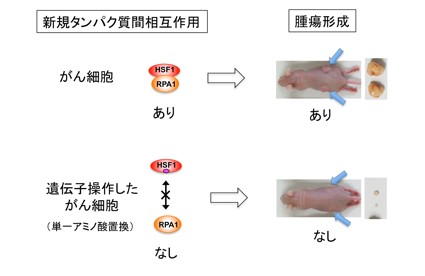
概要図 新規タンパク質相互作用を断つと腫瘍形成はない
【背景】
わたしたちのからだをつくる細胞の成分のうち最も多いものがタンパク質で、全体の約70%を占めています。タンパク質の情報は、ゲノムDNA上に遺伝子としてコード(暗号化)されており、1つの細胞ではおよそ10%の遺伝情報*1が読み取られ(転写)、最終的にそれぞれ固有の機能を持つタンパク質が合成されます。細胞は、これらの様々な機能を持つタンパク質群によって営まれる組織化された1つの社会ととらえることができます。したがって、タンパク質を正しい状態に保つことが、細胞の営み、さらにはわたしたちの健康にとても重要です。
タンパク質は、アミノ酸が一列に並んだひも状のもので、それが正しく折れたたまれる(フォールディング*2)ことではじめて働くことができます。不可逆的にミスフォールディングされたタンパク質は分解によって処理されます。タンパク質ホメオスタシスは、細胞内タンパク質の量と質を一定に保つことであり、タンパク質の合成とともに、フォールディング、分解のバランスによって保たれています。タンパク質ホメオスタシスが損なわれると、老化が促進され、アルツハイマー病、パーキンソン病、糖尿病などの老化と関連する疾患群を発症することが知られています。
細胞には、外界からのストレスや遺伝的要因などによるタンパク質のミスフォールディングが生じてもホメオスタシスを保つための仕組みが備わっています。その中でも重要なのが、熱ショック応答*3と呼ばれる転写調節を介する適応機構です。これは、フォールディングと分解を助けるいわゆるストレスタンパク質の転写を誘導することで、増加した異常タンパク質を再フォールディングか分解により適切に処理してタンパク質ホメオスタシスを保つ仕組みです。つまり、異常なタンパク質の負荷に対して、タンパク質ホメオスタシスを一定に保つことができる容量(タンパク質ホメオスタシス容量)は、熱ショック応答により調節されているのです。がん細胞*4は、この適応機構を強く発揮させて、それを利用することで、ストレス条件下でも増殖できることが知られています。
この熱ショック応答を調節するのが熱ショック因子HSF1(Heat Shock Factor 1)*5とよばれる転写調節因子です。HSF1は、ストレスタンパク質をコードする遺伝子に結合することでその転写量を亢進します。しかし、一般に、遺伝子を含むDNAはヒストンタンパク質と複合体を形成してヌクレオソーム*6とよばれる構造を形成しているため、通常は転写調節因子がDNAに結合できません(図1)。したがって、転写調節因子HSF1がヌクレオソーム構造をとるDNAに最初に結合する仕組みの解明は、タンパク質ホメオスタシス容量を調節する基本的な過程であるにもかかわらず、長い間、未解明のままでした。
【研究の成果】
研究グループは、ヒトHEK293細胞にFlag標識を付けたヒトHSF1を発現させ、抗Flag抗体を用いて共沈降するタンパク質群を質量分析法*7によって網羅的に同定しました。その中で、DNAの複製、修復、組み換えなどのDNA代謝を担うことが知られているRPA1を同定しました。HSF1は、winged helix-turn-helix型のDNA結合ドメインをもつ転写調節因子です。RPA1は、このドメイン内のwing motifに結合することが分りました(図2)。特に、ヒトHSF1の87番目のグリシンは相互作用に必要で、それをアラニンに変えた変異体HSF1G87AはRPA1と結合できませんでした。HSF1は酵母からヒトまで進化の過程で良く保存された因子ですが、驚くべきことに、wing motifの13 アミノ酸の中でこのグリシンだけがすべての種のHSF1で保存されています。
HSF1は通常、ストレス遺伝子の上流で、転写量の調節に働くプロモーターへ結合します。研究グループは、細胞内で、HSF1が結合しているHSP70(ストレス遺伝子の一つ)のプロモーターには、同時にRPA1も存在することをクロマチン免疫沈降法*8で示しました。そして、RPA1をノックダウン法により減少させると、HSF1がHSP70のプロモーターに結合できなることを発見しました(図3)。RPA1と結合できない変異体HSF1G87Aに置換すると、HSF1G87AもRPA1もプロモーター上に存在できません。つまり、HSF1はRPA1と複合体を形成することでプロモーターに結合できることが明らかとなりました。さらに、この複合体によって、DNAとヒストンタンパク質からなるヌクレオソーム構造からヒストンタンパク質が除かれることが分りました。
RPA1は一本鎖DNAに結合する性質をもちますが、その性質によってヒストンタンパク質を直接除くことはできません。酵母では、RPA1がヒストンタンパク質を除く性質をもつヒストンシャペロン複合体(FACT、facilitates chromatin transcription)*9と結合することが知られていました。研究グループは、HSF1-RPA1複合体がFACTを引き寄せることでHSP70のプロモーターのヒストンタンパク質が除かれることを明らかにしました(図4)。
HSF1-RPA1-FACTによるヒストンタンパク質の除去とその結合が、一般的な仕組みかどうかを明らかにするために、DNAマイクロアレイ解析*10により遺伝子発現がHSF1あるいはRPA1に依存する遺伝子群を同定しました。その結果、HSF1に依存する遺伝子群のうち70%のものがRPA1にも依存していました。一部の遺伝子のプロモーターを解析したところ、すべてHSF1-RPA1-FACT複合体が存在していました。以上の結果は、HSF1の機能にRPA1は必須であることを示唆しています。HSF1は、がん細胞の増殖に必要であることが知られています。研究グループは、ヒト悪性黒色腫の細胞株のHSF1をHSF1G87Aへ置換すると、細胞の増殖が遅くなり、さらにマウス体内で腫瘍を形成しないことを明らかにしました(図5)。
【研究の意義と今後の展望】
HSF1による熱ショック応答の研究の歴史は古く、特に、ショウジョウバエをモデルとした研究が精力的に進められてきました。それによると、GAF因子があらかじめHSP70プロモーターのヒストンタンパク質を除いておき、HSF1はストレス条件下でのみDNAへ結合して転写調節を行うとされていました。しかし、当該研究グループの研究をはじめとして、外的ストレスのない条件下の培養細胞やマウス個体でもHSF1が常にDNAに結合することで、タンパク質ホメオスタシス容量を保ち、老化や老化と関連する疾患群の進行を抑制することが示唆されてきました。本研究により、HSF1が非ストレス条件下でDNAへ結合する仕組を明らかにすることで、一連の議論に決着がついたといえます(図6)。HSF1は生理的な条件下で、絶えずタンパク質ホメオスタシス容量を調節しています。
一般に、転写調節因子がヌクレオソーム構造をとる遺伝子に安定に結合する仕組みについてはよくわかっていませんでした。DNAはヒストンタンパク質におよそ2回巻き付いてヌクレオソーム構造を形成していますが、この構造は流動的で、DNAが巻き付いては離れることを繰り返しています。転写調節因子が、ヒストンタンパク質から離れたDNAに結合したとしても、すぐにヒストンタンパク質と競合して除かれます。本研究により、転写調節因子HSF1がヒストンタンパク質を除くFACTを引き寄せることで、安定にDNAに結合することを世界ではじめて明らかにしました(図6)。
ヒトの様々ながん組織においてストレスタンパク質の発現が上昇していることが知られています。最近、その転写調節をになうHSF1の発現も前立腺がん、肝細胞、乳がんなどで上昇していることが明らかになってきました。さらに、様々な組織由来のがん細胞の増殖がHSF1に依存することが示され、HSF1ががん治療のターゲットとして注目を集めるようになりました。HSF1は、正常な細胞の増殖には必要ないが、がん細胞の増殖に特異的に作用するのが特徴です。本研究により、HSF1-RPA1の相互作用が、がんの治療ターゲットとして有望であることが示されました。この相互作用を断ち切る化合物を見いだすことで、がん細胞特異的に増殖を阻害できる可能性があります。
<論文情報>
M. Fujimoto, E. Takaki, R. Takii, K. Tan, R. Prakasam, N. Hayashida, S. Iemura, T. Natsume, and A. Nakai. RPA Assists HSF1 Access to Nucleosomal DNA by Recruiting Histone Chaperone FACT. Mol. Cell, 2012, in press.
<問い合わせ先>
国立大学法人山口大学大学院医学系研究科 医化学分野
教授 中井 彰
TEL: 0836-22-2214 FAX: 0836-22-2315
<補足説明>
*1 遺伝情報
ゲノムDNAに書き込まれた塩基配列の情報で、一つひとつが遺伝子として存在する。動物細胞では、一つの遺伝子の情報をもつDNAが読み取られて、相同な塩基をもつRNAができる。この過程は転写とよばれる。次に、RNAの塩基配列からなる暗号は、翻訳されてタンパク質ができる。DNAからタンパク質ができるまでの流れを、遺伝情報発現とよぶ。
* 2 タンパク質のフォールディング
タンパク質は、アミノ酸が一列に並んだひも状のもので、それが折りたたまれることでそれぞれ決められた立体構造をつくる。この折れたたまれる過程をフォールディングと呼ぶ。立体構造の情報はタンパク質自身が持っているが、HSPが相互作用することで正しい構造をつくるよう助ける。タンパク質のフールディングが異常になると、たがいに会合して凝集体を形成し、細胞毒性を示す。
* 3 熱ショック応答
ある生育温度で維持されている細胞を、数度高い温度にさらすといわゆる熱誘導タンパク質あるいはストレスタンパク質とよばれる多種類のタンパク質が誘導される。これはすべての生物がもつ高温に対する適応機構であり、熱ショック応答とよばれる。タンパク質は極めて高温に感受性が高いため、タンパク質ミスフォールディングに対する適応機構ともいえる。発見の歴史上、温熱ストレスによって顕著に誘導される一群のものは、熱ショックタンパク質(Heat shock protein: HSP)と名付けられた。HSPは、細胞内のすべてのタンパク質のフォールディングを介助する。それ以外にも、タンパク質の分解を助けるものなどが誘導される。
* 4 がん細胞
様々な組織の細胞が、遺伝子変異によって自律的に増殖し、周囲の組織に浸潤または転移を起こす悪性腫瘍をさす。
* 5 熱ショック因子
熱ショック因子(Heat shock factor: HSF)は、遺伝子の読み取り(転写)を制御する転写調節因子。ヒト細胞でHSPの量を調節するのは主にHSF1である。HSF1は温熱ストレスをはじめとする様々なストレスによるタンパク質のミスフォールディングを感知し、活性化されることでHSPをはじめとするストレスタンパク質の遺伝子上流のプロモーターへ結合し、その転写量を調節する。
* 6 ヌクレオソーム
真核細胞のDNAは、核内においてクロマチン(染色体)として存在する。これは、DNAがヒストンタンパク質におよそ2回巻き付いたヌクレオソームとよばれる基本単位が、より複雑に凝集してできた構造である。転写や複製の際には、この構造が弛緩されてヒストンタンパク質が除かれることで、様々な因子がDNAと結合できる。
*7 質量分析法
タンパク質を酵素で切断し、長さの異なるアミノ酸配列断片についてそれぞれの質量を測定する。その質量からアミノ酸の種類を同定する方法。
*8 クロマチン免疫沈降法
細胞内で、あるタンパク質がクロマチンを構成するDNA領域に存在するかどうかを調べる方法である。目的とするタンパク質に対する抗体を用いて、そのタンパク質を沈降させたときに同時に沈降するDNAを同定する。
* 9 ヒストンシャペロン
ヒストンタンパク質と結合し、そのDNAとの会合あるいは脱離を補助するタンパク質をさす。ヌクレオソームの形成あるいは分解に重要な役割を担う。
*10 DNAマイクロアレイ解析
細胞の持つ全ての遺伝子の発現をRNAレベルで定量的に計測する方法である。スライドガラス上に数千から数万個のDNA断片をのせ、細胞から抽出したRNAとハイブリッドを形成させ、ハイブリッド形成の強度を指標にして各遺伝子の転写量を測定する。
<図と説明>
図1 HSF1は単独ではヌクレオソームを形成するDNAに結合できない
遺伝子の上流のプロモーターにHSF1の結合配列(HSE)が存在しても、HSF1単独で安定に結合することができない。ショウジョウバエの研究では、GAFとよばれる因子があらかじめプロモーターに結合してヌクレオソーム構造を分解するので、HSF1は活性化することで速やかに結合できる。しかし、動物細胞にはGAFがないので、HSF1がどのような仕組みで細胞内のDNAに結合するか不明であった。
図2 RPA1はHSF1のwing motifに結合する
HSF1のDNA結合ドメインはwinged helix-turn-helix型の構造をもつ(左)。その中の、特定の構造をとらず、外側に露出しているwing motifがRPA1と相互作用する。87番目のグリシン(G)をアラニン(A)またはセリン(S)に置換した変異体(hHSF1-G87A、hHSF1-G87S)は、共沈降実験でRPA1との結合が検出されない(右)。
図3 HSF1のDNAへの結合にはRPA1が必要である
HSF1およびRPA1がHSP70遺伝子のプロモーター(上)へ結合するかどうかをクロマチン免疫沈降法(ChIP法)で調べた。RPA1のノックダウン(mRPA1-KD1 or KD2)によりHSF1がその結合配列(pHSEとdHSE)に結合できなくなり、HSF1のノックダウン(mHSF1-KD1 or KD2)によりRPA1が結合できなくなる(下)。*印は有為差を示す(p<0.01、Student t検定)。
図4 HSF1-RPA1はFACTを引き寄せることでヒストンタンパク質を除く
ヒストンシャペロン複合体FACT(SPT16とSSRP1の二量体)(左)はHSP70遺伝子のプロモーターへ結合している。しかし、RPA1またはHSF1のノックダウンにより結合できなくなる(中)。さらに、SPT16のノックダウンによりヒストンH2Bがプロモーター上に増加する、つまりヌクレオソームの形成がより進んでいる。*印は有為差を示す(p<0.01、Student t検定)。
図5 HSF1-RPA1相互作用は腫瘍形成に必要である
ヒトメラノーマ細胞株HMV-1を用いて、内在性のHSF1をGFP、野生型HSF1(hHSF1-HA)、あるいは相互作用変異体(G87S-HA、G87A-HA)に置換した。その細胞をヌードマウスの背部皮下の2カ所に移植した(n=8)。代表的な腫瘍を形成したマウス及び摘出した腫瘍の写真(28日後)を示す(左)。腫瘍の容量変化の時間経過を示す(右)。*印は有為差を示す(p<0.01、ANOVA検定)。
図6 RPA1はFACTを引き寄せることでHSF1のDNAの結合を助ける
ストレスのない生理的条件下で、DNA非結合型の単量体HSF1とDNA結合型の三量体HSF1の平衡状態が単量体側に片寄っている。わずかに存在する三量体HSF1は、RPAと結合することでFACTを引き寄せて、さらにクロマチンリモデリング因子であるSWI/SNF複合体(Brg1複合体)と協力してヒストンタンパク質を除く。その結果、HSF1は安定にプロモーターへ結合し、RNAポリメラーゼII(Pol II)を含む転写開始前複合体を引き寄せることで転写を進める。この構成的な転写調節は、タンパク質ホメオスタシスに必要である。また、この調節がないとがん細胞の増殖が顕著に抑制される。