熱ショック因子HSF1は転写因子NFATと協調してタンパク質毒性を軽減する(医化学分野)
N. Hayashida, M. Fujimoto, K. Tan, R. Prakasam, T. Shinkawa, L. Li, H. Ichikawa, R. Takii, and A. Nakai.
Heat shock factor 1 ameliorates proteotoxicity in cooperation with the transcription factor NFAT. EMBO J., 29, 345-3469, 2010.
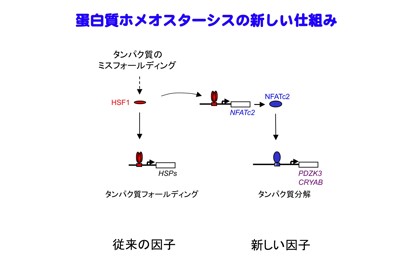
細胞内のタンパク質ホメオスタシスは、主にそのフォールディング(折れたたみ)と分解のバランスで保たれている。その分子機構の一つは、熱ストレスに曝された細胞が、タンパク質のフォールディングを助ける熱ショックタンパク質(heat shock protein: HSP)の量を増やす熱ショック応答の機構で、この応答を調節する鍵となる転写因子が熱ショック因子HSF1(heat shock factor 1)である。この適応機構で対応できないほどのタンパク質のフォールディングの異常は、アルツハイマー病をはじめとする神経変性疾患等のいわゆるタンパク質ミスフォールディング病を引きおこす。これらの病態進行に対して、HSF1が極めて有効であることが明らかにされているが、HSF1の不必要な活性化は細胞に有害であることも知られており、新たな因子の解明が待たれていた。
研究グループは、HSF1によって作動するヒトの因子を探索し、そのうちタンパク質のフォールディングの異常を強く抑制する調節因子NFATを発見した。神経変性疾患の中でも代表的なポリグルタミン病のモデルマウスで、NFATを欠損すると、HSF1欠損と同様に、ポリグルタミンタンパク質がフォールディングの異常により速やかに神経細胞に蓄積し、神経症状が現れ、早期に死に至ることが判明した。さらに、NFATは異常なタンパク質の分解を助けるPDZK3とCRYABを誘導することでタンパク質ホメオスタシスを保つことが明らかになった。
この研究成果は、古くから知られている熱ストレスに対する適応機構の定説を覆すと同時に、神経変性疾患等のタンパク質ミスフォールディング病の治療に新たな方向性を示すものである。
本研究は、「EMBO Journal」電子版(9月10日付け)のハイライトとしてトップページで紹介された。