熱ショック因子HSF2は発熱レベルの熱ストレスやポリグルタミン蛋白質存在下での蛋白質恒常性維持に必要である
T. Shinkawa, K. Tan, M. Fujimoto, N. Hayashida, K. Yamamoto, E. Takaki, R. Takii, R. Prakasam, S. Inouye, V. Mezger, and A. Nakai.
Heat shock factor 2 is required for maintaining proteostasis against febrile range thermal stress and polyglutamine aggregation.
Mol. Biol. Cell, 22, 3571-3583, 2011.
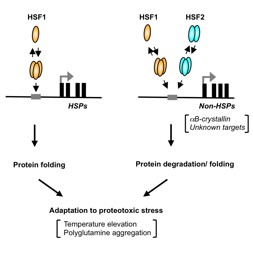
細胞内のタンパク質ホメオスタシスは、主にそのフォールディングと分解のバランスで保たれている。その分子機構の一つは、熱ストレスに曝された細胞がひき起こす応答で、タンパク質のフォールディングを助ける熱ショックタンパク質(heat shock protein: HSP)だけでなく、分解を助ける因子群(CRYAB、PDZK3、NFAT)の量も増やす機構であることが我々の研究から明らかになってきた(Review; Hayashida et al. Transcription 2011)。この応答を調節する鍵となる転写因子が熱ショック因子HSF1(heat shock factor 1)である。この適応機構で対応できないほどのタンパク質のフォールディングの異常は、アルツハイマー病をはじめとする神経変性疾患等のいわゆるタンパク質ミスフォールディング病を引きおこす。これらの病態進行に対して、HSF1活性化が極めて有効であることが明らかにされているが、HSF1の不必要な活性化は細胞に有害であることも知られており、新たな因子の解明が待たれている。
高等動物細胞のHSFは遺伝子ファミリーを形成しており、4つの遺伝子(HSF1-4)が知られている。HSF1以外のHSFは、HSPの誘導に必要ではなく、神経や生殖器、さらには感覚器の発生や維持に必要であることが知られている。しかし、その発見から20年の間、蛋白質ホメオスタシスへの関与については全く明らかにされていなかった。我々は、HSF2欠損ニワトリBリンパ球細胞が極めて温熱感受性が高いことを見いだし、HSF2がタンパク質恒常性に重要な役割を担っている可能性を推測した。実際に、マウス胎児繊維芽細胞(MEF)を用いた実験から、HSF2が発熱レベルの熱ストレスで活性化すること、HSF2欠損細胞はそのストレスに感受性が高くなることが分った。また、凝集する傾向があるポリグルタミン蛋白質を発現させると、HSF2欠損細胞では凝集体形成をより起こしやすいことも分った。さらに、蛋白質ミスフォールド病の一つであるハンチントン病モデルマウスを用いた実験から、HSF2の欠損は病態進行を促進し、寿命を短縮することを明らかにした。HSF2の効果の一部は、aB-crystallinの発現を介していた。以上の結果は、non-HSP経路を作動するHSF2がストレス条件下での蛋白質恒常性維持に必要であることをはじめて明らかにし、蛋白質ミスフォールド病の新たな治療ターゲットの可能性を示唆する。
本研究は、MBoCハイライトに選ばれ、米国細胞生物学会ニュースレターでも紹介される。