脳とこころの発達に重要な因子を発見
~精神・神経疾患の原因解明へ前進~
【ポイント】
• 脳神経細胞の発達に重要な因子を発見
• 情動行動の発達に重要な因子を発見
• 脳内タンパク質ホメオスタシスが脳と行動の発達に重要
【研究の背景】
近年、幼児虐待や育児放棄、キレる子供の増加による犯罪の低年齢化などが社会問題となっています。養育期の環境がその後の脳の発達に影響を及ぼすことが知られており、養育期の環境ストレスが成人になってからのストレスへの感じやすさを高める(ストレス脆弱性)と考えられています。さらに、最近のストレス社会を背景に、うつ病*1などの精神疾患を発症する人が急増しています。私たち人間の脳には、ストレスを受けてもそれを乗り越えるシステムが備わっているため、通常の生活を送ることができます。しかし、一部の人はストレスに適応することができずにうつ病や不安障害、統合失調症などの精神疾患にかかってしまいます。また、このような環境要因とともに遺伝的要因によっても精神疾患へのかかりやすさが決まっていることも指摘されています。しかしどの遺伝子が脳と行動の発達に関与しているかについてはあまり知られていません。
私たちの脳には膨大な数の神経細胞があり、複雑な神経ネットワークを形成しています。神経細胞の機能を正常に維持するためには、個々の神経細胞内におけるタンパク質ホメオスタシス(恒常性)*2が重要です。この仕組みに異常が生じると、神経ネットワークが正常に作動しなくなり、行動や記憶形成などの脳高次機能に障害を与えると考えられています。細胞内のタンパク質は、通常、その量と質がほぼ一定に保たれており、この状態は「タンパク質ホメオスタシス(恒常性)が保たれている」といわれます。タンパク質ホメオスタシスに最重要な分子として熱ショック因子(heat shock factor: HSF1*3)が知られています。しかし、HSF1の脳における役割については不明でした。
研究グループは、HSF1による脳内タンパク質ホメオスタシスの維持が神経細胞や行動の発達に重要ではないかと考え、HSF1をもたないマウス(HSF1欠損マウス)を用いて、このマウスの神経細胞や行動パターンを詳細に検討しました。
【研究の成果】
1. HSF1欠損マウスの神経細胞 (図1)
研究グループは、HSF1欠損マウスと野生型マウスの海馬歯状回*4とよばれる場所の神経細胞を観察しました。その結果、HSF1欠損マウスの神経細胞では、情報を受け取るスパイン*5と呼ばれる構造物の密度が有意に低下していました。また、HSF1欠損マウスの神経細胞の樹状突起*5と呼ばれるスパインを多くもつ枝分かれした構造物の長さも短くなっていました。つまり、HSF1欠損マウスの神経細胞は、他の神経細胞からの情報を的確に受け取るのが困難な状態であることが分かりました。
次に、HSF1欠損マウスの海馬歯状回で新しく産生された神経細胞(神経新生)の数を解析しました。その結果、HSF1欠損マウスは野生型マウスに比べて新しい神経細胞の数が少ないことが分かりました。これらの結果から、HSF1が神経細胞の発達や神経新生に重要な因子であることが示唆されました。
2. HSF1欠損マウスにおける行動異常(図2)
次に、HSF1欠損マウスを用いて様々な行動学的解析*6を行いました。その結果、HSF1欠損マウスは不安行動が減少し、逆にうつ様行動は増加していました。また、HSF1欠損マウスの社交性は低下しており、攻撃行動は増加していました。これらの結果から、HSF1は情動行動制御に重要な因子であることが示唆されました。
3. HSF1の機能を正常に戻す (図3)
HSF1欠損マウスの海馬で人為的にHSF1を増やす操作(レスキュー実験)を行うと正常な行動に戻るかどうかを調べました。その結果、産まれてすぐのHSF1欠損マウスの海馬でHSF1を増やすと、このマウスの不安行動やうつ様行動は正常マウスの行動と同レベルになりました。一方、成獣になってからHSF1を増やす操作を行っても行動は元にもどりませんでした。この結果から、生後の早い段階におけるHSF1の機能が行動の発達に関与していることが示唆されました。
4. HSF1による行動発達の仕組み (図4)
HSF1は様々な遺伝子の活性のオン・オフのスイッチとしての役割を担っていることがわかっています。そこで研究グループは、HSF1がどの遺伝子の活性を制御することで脳と行動の発達に関与しているのかについて調べました。その結果、HSF1はポリシアル化酵素遺伝子群の量を調節していることを突きとめました。また、HSF1欠損マウスでは、細胞接着因子NCAM*7のポリシアル化*7が減少していました。さらに、HSF1欠損マウスの海馬でHSF1を増やす操作を行ったところ、ポリシアル化酵素遺伝子群とNCAMのポリシアル化は正常レベルに回復していました。これらの結果から、HSF1はポリシアル化酵素遺伝子の活性を制御することでNCAMのポリシアル化の量を調節する重要な因子であることが示唆されました。
5. NCAMのポリシアル化と行動発達 (図5)
最後に、NCAMのポリシアル化を阻害する薬剤(endo-N)を海馬に投与したマウスを作製し、このマウスの行動を観察しました。産まれてすぐのマウス海馬にendo-Nを投与し、成獣になってから行動を観察したところ、不安行動の減少、うつ様行動の増加が観察され、これはHSF1欠損マウスと同様の異常行動でした。一方、成獣マウスの海馬にendo-Nを投与しても異常行動は観察されませんでした。これらの結果から、生後早い段階におけるHSF1を介したNCAMのポリシアル化調節が脳と行動の発達に重要であることが強く示唆されました。
【今後の展開】
うつ病や不安障害などの精神疾患は単一の遺伝子のみで説明できる疾患ではなく、複数の因子が複雑に相互作用していると考えられています。今回の研究結果から、脳神経細胞の発達と情動行動の発達に重要な因子として新たにHSF1を同定することに成功しました。養育期の環境ストレスや遺伝的要因によってHSF1の機能に異常が生じると、脳やこころの発達に影響を及ぼす可能性があることを示唆する研究成果です。HSF1の機能を増強する薬剤開発によって脳やこころの発達異常を改善できる可能性があります。今後HSF1と相互作用する様々な因子の脳内タンパク質ホメオスタシスに対する役割をさらに検討することによって、脳とこころの発達の仕組みの全容を解明していく必要があります。
【図及び説明】
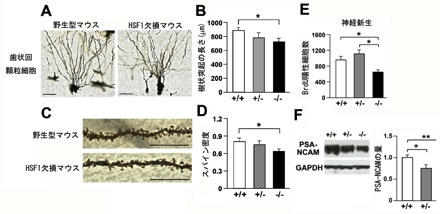
図1 HSF1欠損マウスの神経細胞
HSF1欠損マウスの海馬歯状回における神経細胞の形態を観察したところ、樹状突起の長さは短く(図A,B)、樹状突起上に存在するスパインの密度も低下していました(図C,D)。HSF1欠損マウスの海馬歯状回における新しく産生された神経細胞数を測定したところ、野生型マウスに比べて有意に低下していました(図E)。また新しく産生されたニューロンのマーカーであるPSA-NCAMの量を測定した結果、HSF1欠損マウスではその量が有意に減っていました(図F)。以上の結果から、HSF1は神経細胞の発達や神経新生に重要な因子であることが示唆されました。
図2 HSF1欠損マウスにおける行動異常
HSF1欠損マウスの不安行動をNovelty-suppressed feedingテスト(図A)とオープンフィールドテスト(図B)を用いて検討しました。その結果、HSF1欠損マウスの不安行動は有意に減少していました。
HSF1欠損マウスのうつ様行動を強制水泳試験(図C)とスクロースプレファレンステスト(図D)を用いて検討しました。その結果、HSF1欠損マウスのうつ様行動は有意に増加していました。
HSF1欠損マウスの社交性をソーシャルインタラクションテストを用いて検討しました(図E)。その結果、HSF1欠損マウスの社交性は有意に低下していました。
HSF1欠損マウスの攻撃性をソーシャルレジデントイントゥルーダーテストを用いて検討しました(図F)。その結果、HSF1欠損マウスの攻撃は有意に増加していました。
図3 HSF1の機能を正常に戻す
出生直後のHSF1欠損マウスの海馬に恒常的活性化型のHSF1(caHSF1)を人為的に過剰発現させ、成獣になってからの行動を評価しました。対照群にはEGFPを過剰発現させました。caHSF1を過剰発現させたマウスは、対照群に比べてnovelty-suppressed feeding testにおけるエサを食べるまでの時間が有意に長くなっていました(図A)。また、強制水泳試験において、caHSF1を過剰発現させたマウスは、対照群に比べて無動時間が有意に短くなっていました(図B)。以上の結果から、マウス海馬におけるHSF1の機能が情動行動の発達に重要であることが示唆されました。
図4 HSF1による行動発達の仕組み
HSF1欠損マウスの海馬におけるポリシアル化酵素遺伝子群のmRNA発現量を測定した結果、st8siaIIとst8siaIV発現量は野生型マウスに比べて有意に減少していました(図A,B)。また、HSF1欠損マウスの海馬に恒常的活性化型のHSF1(caHSF1)を人為的に過剰発現させると、ポリシアル化酵素遺伝子群の発現量は正常レベルに回復しました(図C)。さらに、HSF1欠損マウスの海馬にcaHSF1を過剰発現させると、PSA-NCAMの量は正常レベルに回復しました。以上の結果から、HSF1がポリシアル化酵素群の転写を制御することでPSA-NCAMの量を調節していることが示唆されました。
図5 NCAMのポリシアル化と行動発達
出生直後のマウス海馬にNCAMのポリシアル化を阻害する薬剤(Endo-N)を注入しました(図A)。緑色がPSA-NCAM、青色は核をそれぞれ染色した様子。Endo-Nを注入した海馬では、PSA-NCAMが検出できていないのが分かります。このマウスが成獣になってから行動を評価したところ、novelty-suppressed feedingテストではエサを食べるまでの時間が短くなり(図B)、強制水泳試験では無動時間が長くなっていました(図C)。つまり、HSF1欠損マウスと同様の異常行動を示しました。この結果から、HSF1を介したPSA-NACMの調節が行動の発達に重要な仕組みであることが示唆されました。
【用語説明】
*1)うつ病
米国の操作的診断基準であるDSM-IV-TRでは、「大うつ病性障害」(major depression)と呼ばれている。DSM-IVの診断基準は、「抑うつ気分」と「興味・喜びの喪失」の2つの主要症状が基本となる。「抑うつ気分」とは、気分の落ち込みや空虚感・悲しさなどである。「興味・喜びの喪失」とは、以前楽しめていたこと(趣味など)にも楽しみを見いだせない状態である。これら主要症状に加えて、「抑うつ気分」と類似した症状として、「自分には何の価値もないと感じる無価値感」、や「自殺念慮・希死念慮」などがある。
*2) タンパク質ホメオスタシス(恒常性)
細胞内タンパク質の量と質を一定に保つこと。タンパク質ホメオスタシスは、タンパク質の合成、フォールディング、分解などのバランスで保たれている。
*3) HSF1
熱ショック因子(Heat shock factor: HSF)にはHSF1からHSF4まで4つ存在する。どれも、遺伝子の読み取り(転写)を制御する調節因子。HSF1は温熱ストレスをはじめとする様々なストレスによるタンパク質の異常な立体構造(ミスフォールディング)を感知し、活性化されることでタンパク質のミスフォールディングを介助する。
*4) 海馬歯状回
大脳辺縁系の1部分で、記憶・情動・ストレス応答に重要な脳部位とされている。解剖学的には海馬と歯状回は別物であるが、慣例的にそれら2つをまとめて「海馬」と呼んでいる。歯状回では新しい神経細胞が産生されている。
*5) スパイン、樹状突起
樹状突起は神経細胞体から木の枝のように分岐しながら広がっている構造をしており、他の細胞からの情報を受け取るはたらきをしている。樹状突起上には他の神経細胞からの情報を受け取る棘突起(スパイン)が無数に存在し、シナプスを形成している。この棘突起は神経活動に依存して形態が変化したり移動することで神経可塑性に影響を与えていると考えられている。
*6)行動学的解析
・Novelty-suppressed feedingテスト(不安行動を調べる試験)
新規フィールドの中央にエサをおき、マウスがエサを食べるまでの時間を測定する。不安が増大しているマウスはフィールドの中央には行きづらく、端を好んで滞在する性質があるため、エサを食べるまでの時間が長くなる。逆に、不安が少ないマウスはエサを食べるまでの時間が短縮する。
・オープンフィールドテスト(不安行動を調べる試験)
40cm四方の箱の中にマウスをいれ、自由に行動させる。このとき、マウスがフィールドの中央部分に滞在した時間の割合を測定する。上記試験と同様に、不安が減少しているマウスは、フィールドの中央部分に滞在する時間が増加する。
・強制水泳試験 (絶望状態を調べる試験:うつ様行動)
逃げ場のない水の中で強制的にマウスを泳がせる。このときマウスは水から脱出しようと試みるが、そのうちあきらめて(絶望して)全く泳がなくなる。この身動きしない時間の長さを指標として、マウスの絶望状態を調べることができる。
・スクロースプレファレンステスト (無感症を調べる試験:うつ様行動)
スクロース溶液あるいは通常水の入ったボトルを同時にマウスに与え、スクロース溶液を飲んだ割合を測定する。通常のマウスは甘いスクロース水を好んで飲むが、無感症(anhedonia)の状態のマウスはスクロース溶液を飲む割合が少なくなる。
・ソーシャルインタラクションテスト (相手マウスへの興味を調べる試験:社交性)
はじめて接するマウスに対してどの程度興味をもっているかを調べるテスト。
・ソーシャルレジデントイントゥルーダーテスト(攻撃行動)
テストするマウスのケージにはじめて接触するマウスを入れ、テストマウスが相手マウスに攻撃をしかけるまでの時間を測定する。
*7)NCAM、ポリシアル化
神経細胞接着因子NCAMは、神経細胞の移動、軸索誘導、シナプス形成、スパイン形成などに重要な因子。ポリシアル酸は神経細胞のみに認められ他の細胞にはみられない糖鎖のことで、ポリシアル化されたNCAMは出生後から次第にその量が減っていき、成獣マウスにはほとんど存在しない。ポリシアル化NCAMは神経系の発達に重要な因子である。