宇部興産学術振興財団 特別講演及び2010年度学術奨励賞贈呈式
2011年6月3日(金)
http://www.ube-ind.co.jp/ube_s_zaidan/
特別講演
明日の医療:「タンパク質から迫る老化と病気」
山口大学大学院医学系研究科医化学分野
中井 彰
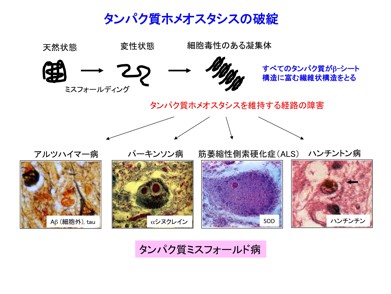
私たち生物は、体内の生理的変化や外部環境変化にさらされながらも、ある一定の内部環境を安定に維持している。このような仕組みは、一般にストレス応答とも呼ばれ、細胞や組織のホメオスタシス(homeostasis、恒常性)の維持に必須のものである。それらの仕組みを凌駕する変化によって安定な環境を維持できなくなった状態が病気といえる。長い時間経過でとらえると、すべての生物の内部環境は必ず時間とともに変化してゆき、最終的には死に至る。これが老化と寿命であるが、個体の老化は、それをつくる細胞の老化によって引きこされる。一般に、細胞の老化を「細胞機能の減衰」と定義することができ、細胞構成成分であるゲノムDNA、タンパク質、そして代謝に重要なミトコンドリア等の恒常性が保たれなくなる状態といえる。その中でも、タンパク質は細胞機能を担う主役であり、その量と質がほぼ一定に保たれている。この状態は、タンパク質ホメオスタシスと呼ばれ、タンパク質の合成、フォールディング(折りたたみ)、分解等のバランスで維持されている。その破綻は、タンパク質の変性、さらには細胞毒性のある凝集体の形成を導き、老化、さらに老化と関連するタンパク質ミスフォールド病と総称される神経変性疾患群(アルツハイマー病やパーキンソン病など)などをひき起すことが分ってきた(図)。
タンパク質は温熱ストレスに感受性が強く、容易に変性される。それを防ぐために、細胞は一群の熱ショックタンパク質(heat shock protein、HSP)を誘導する。このHSP群は、細胞内のタンパク質の正しいフォールディング(折りたたみ)を助ける働きがあることから、シャペロン(昔、社交界などで若い女性に付き添った婦人)とも呼ばれる。この細胞応答は、熱ストレス応答として古くから知られており、細菌からヒトに至るまで進化の過程でよく保存された生物の適応機構である。
私たちは、20年前に、ニワトリ、マウス、ヒトの細胞を材料として、HSPの遺伝子スイッチである熱ショック因子(heat shock factor、HSF)の分子クローニングを行うところから研究をスタートした。高等脊椎動物には4つのHSF(HSF1-4)が存在し、ニワトリ細胞ではHSF3がHSPの遺伝子スイッチであった。また、熱ストレス応答が、確かに細胞の生存に重要であることを高等動物細胞で初めて明らかにした。一方、哺乳動物細胞ではHSF1がHSPの遺伝子スイッチであることが明らかにされたが、それ以外のHSF群の役割は細胞の解析では不明であった。2000年以降、HSF群の生理機能を明らかにするために遺伝子破壊マウスの解析が世界中で精力的になされ、脳神経細胞と生殖細胞の形成に必要であることが明らかとなった。私たちは、独自に、HSF群が感覚器組織の維持に必要で、それらの欠損は老化とともに異常をひき起すことを見いだした。同じ頃、HSFの働きを増強することでわずか1mmの線虫の寿命が伸長すること、さらにタンパク質ミスフォールド病モデル線虫の寿命も延ばすことが明らかにされた。私たちは、ヒトに近いマウスをモデルとすることで、HSFの働きとタンパク質ミスフォールド病の病態進行と寿命が関連していることを明らかにした。特に、HSPとは別の、タンパク質分解に関わる遺伝子の発現制御がHSFの効果に大きく寄与しているという発見は、古くから知られている熱ストレス応答の研究を新しい展開へと導いた。近年、治療法のない神経変性疾患等の老化と関連する疾患群に対し、化合物を用いて熱ストレス応答を増強しようとする試みが世界中で進められている。本講演では、タンパク質の研究が、私たちに身近な多くの病気と関連していること、それらの治療への期待について紹介したい。