岡田さんが学位を取得しました
岡田真理子さんが2023年9月に医学博士の学位を取得しました。学位論文は「熱ショック遺伝子HSP72のプロモーター由来のHSEアレイ上で液-液相分離するHSF1凝縮体の解析」です。関連論文はFEBS Letters誌の597巻13号(2023年7月)のEditor’s Choiceに選ばれました。
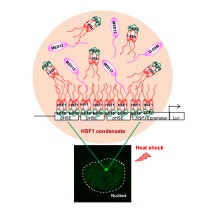
細胞の熱ショック応答の過程で、活性化されたHSF1はHSP遺伝子プロモーターに存在する熱ショック応答配列(HSE)に結合し、メディエーターを含む転写開始前複合体を集積させることで転写を促進します。一般に、転写因子及びその調節因子は液―液相分離によってプロモーター上に凝縮体を形成すると考えられています。しかし、HSP遺伝子プロモーター上でも同様かどうかについては、凝縮体が微小であるために十分な解析ができていません。本研究では、ヒトHSP72プロモーター由来のHSEを多数連結したレポーター遺伝子をマウス細胞に導入しました。このHSEレポーター遺伝子を持つ細胞に蛍光タンパク質mEGFPを融合したHSF1を発現させることで、熱ストレス条件下でHSF1凝縮体を可視化することに成功しました(図1)。この人工的なHSF1凝縮体は部分的に液体様の性質を持つ、すなわち液―液相分離により形成されていました。
また、大腸菌から精製したタンパク質を用いた実験から、HSF1の天然変性領域(IDR)が相分離に寄与することも分かりました。さらにこの実験系を用いて、HSF1凝縮体の形成が転写調節因子によって制御されるかを調べ、ました。特に、熱ショック応答を促進するメディエーターの一つであるMED12に着目して解析したところ、MED12のIDRはHSF1凝縮体に集積すること、そしてMED12の発現抑制はHSF1の凝縮体形成を著しく抑制することが明らかとなりました。本研究は、HSP72プロモーター上のHSF1凝縮体を解析する実験系を提示するとともに、それが転写調節因子によって制御されることを示唆しています。
図1 熱ストレス処理した細胞のmEGFP-hHSF1を観察した(下)。核を点線で囲って示す。想定されるHSFアレイとHSF1凝縮体を模式図で示す(上)。